Inhaltsverzeichnis
Die Tumorerkrankung des Auges ist eine potentiell lebensbedrohliche Situation und wird in den meisten Fällen in Form einer okularen Brachytherapie behandelt. Die am häufigsten auftretende Form ist das Aderhautmelanom das primär in der Aderhaut, im Ziliarkörper und der Iris auftritt. Nach einer gesicherten Diagnose eines Augentumors kann mit der Therapie begonnen werden. Hierzu wird ein Strahlenträger, der Augenapplikator, von außen auf den Augapfel genäht. In Deutschland werden hierzu für Tumore bis zu einer Höhe von bis zu 7mm radioaktive Ruthenium-Applikatoren (Ru-106) der Firma BEBIG verwendet. Dieser Ruthenium-Applikator verbleibt an der entsprechenden Stelle auf dem Augapfel, bis eine ausreichende Dosis appliziert wurde. Alternativtherapien sind die Protonenbestrahlung und die Enukleation.
Applikatoren
Diese sogenannten Ruthenium-Applikatoren werden direkt auf die Sklera genäht, um so den Tumor aus geringer Distanz zu bestrahlen. Der Hersteller dieser Quellen bietet unterschiedliche Größen dieser Augenapplikatoren an, um eine der Größe des Tumors entsprechende Auswahl möglich zu machen. Zusätzlich gibt es auch Sonderformen mit Ausschnitten für den Sehnerv oder die Cornea zur Schonung dieser besonders strahlenempfindlichen Risikostrukturen.
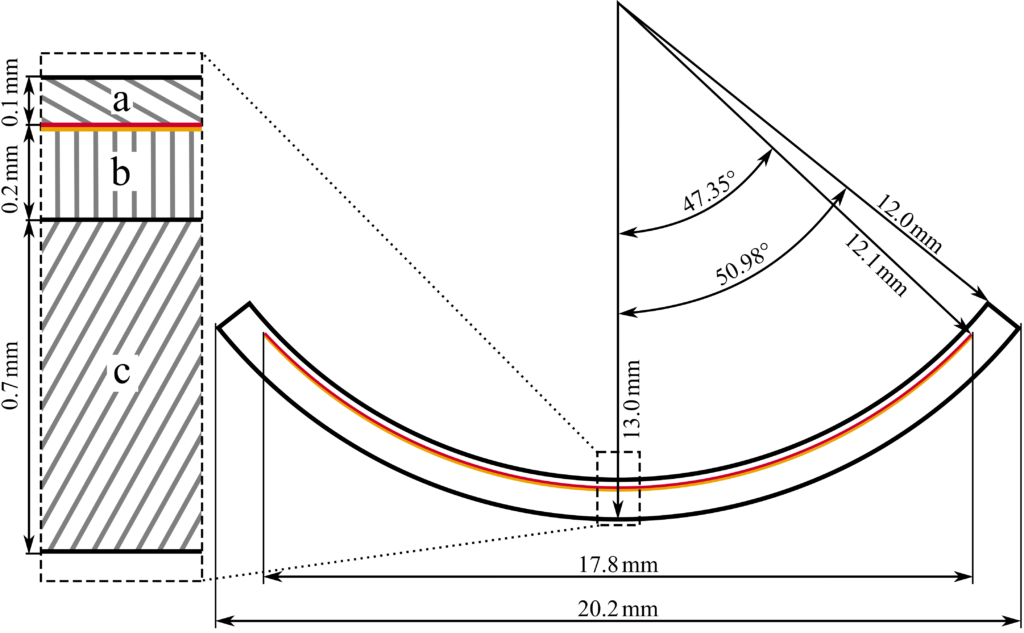
Grundsätzlich haben alle Applikatormodelle den gleichen Aufbau. Sie besitzen eine 0,2 mm dicke Targetfolie, die aus Silber besteht und mit einer Goldbeschichtung mit einer Dicke von (1, 4 ± 0, 6) mm versehen ist, auf die elektrolytisch das radioaktive Ruthenium-106 aufgetragen wird Diese Ruthenium- Schicht besitzt eine Dicke kleiner als 0, 1 mm. Zur konkaven Seite hin ist die Quelle mit einem 0,1 mm dicken Silberaustrittsfenster versehen. Die konvexe Seite ist nach hinten mit einer 0,7 mm Silberschicht abgeschirmt. Herstellungsbedingt reicht die radioaktiv belegte Schicht nicht bis zum geometrischen Rand der Silberkalotte. Daher besitzen alle Applikatoren einen unbelegten Randbereich mit einer Ausdehnung von mindestens 0,75 mm. Bei einigen Modellen wird der inaktive Randbereich bewusst größer gewählt. Die Krümmungsradien der Applikatoren zur Anpassung an den Augapfel betragen 12 mm, 13 mm oder 14 mm.

Ruthenium-106
Ruthenium-106 ist ein β–-Strahler, der mit einer Halbwertszeit von 371,8 Tagen in Rhodium-106 zerfällt. Das Spektrum dieses Zerfalls hat mit Energie im niedrigen zweistellen keV-Bereich keine klinische Relevanz, da die Dicke des Silberaustrittsfensters ausreicht um alle Elektronen zu absorbieren. Rhodium-106 wiederum zerfällt mit einer Halbwertszeit von 30,07 s in das stabile 106-Palladium. Beide Zerfälle haben also nur ein Tochternuklid. Die mittlere Energie des zweiten Zerfalls beträgt 1,41 MeV, die maximale 3,54 MeV. 21,4 % der Palladium-Tochternuklide sind zunächst angeregt und relaxieren unter Aussenden von Gammaquanten.
Dosierung
Maßgabe einer sinnvollen Dosierung ist es, das gesamte Tumorgewebe irreversibel zu schädigen. Das bedeutet, dass eine bestimmte Dosis, die Tumorkontrolldosis, im gesamten Zielvolumen nicht unterschritten werden darf. In der Literatur lässt sich jedoch keine exakte Angabe einer Tumorkontrolldosis für die okulare Brachytherapie mit Ruthenium-Applikatoren finden. Für COMS-Applikatoren (Collaborative Ocular Melanoma Study Group), welche Iod-125 als radioaktiven Strahler verwenden, wird die Tumorkontrolldosis mit 85 Gy am Tumorapex angegeben. Für Ruthenium- Applikatoren werden Dosierungsgrenzen zwischen 70 Gy und 100 Gy für verschiedene Kliniken aufgeführt, sodass von einer auf Erfahrungswerten beruhenden Tumorkontrolldosis für Ruthenium-Applikatoren von (85 ± 15) Gy ausgegangen werden kann. Eine allgemein gültige Vorschrift bei der Dosierung gibt es nicht. Die American Brachytherapy Society gibt lediglich die Empfehlung, immer auf den Tumorapex zu dosieren und die Dosierung so anzupassen, dass im gesamten Tumorgewebe eine ausreichende Dosis appliziert wird. Der limitierende Faktor bei der Dosierung ist die maximal tolerierte Dosis an der Sklera. Diese ist relativ strahlenunempfindlich und verträgt auch Dosen weit über 1000 Gy. Die Maximaldosis ist bei circa 1500 Gy erreicht. Diese hohe Dosis kann Löcher in der Sklera zur Folge haben, die jedoch unbedingt vermieden werden sollten.
Jeder individuelle Applikator des Herstellers BEBIG verfügt über ein Zertifikat. In diesem befindet sich ein Messprotokoll, welches eine gemessene zentrale Tiefendosiskurve, bestehend aus elf Messpunkten bis in einen Abstand von 10mm, und eine Oberflächendosisverteilung, bestehend aus 33 Messpunkten in einem effektiven Abstand von 1mm zur Applikatoroberfläche, besitzt. Dosisinhomogenitäten werden vom Hersteller bis ±20% toleriert. Diese vom Hersteller BEBIG durchgeführten Messungen stellen die Grundlage zur Therapieplanung dar. Die Dosierung erfolgt gemäß der Tumorhöhe, zu der pauschal 1,0-1,2 mm hinzuaddiert werden, um die Ausdehnung der Sklera zu berücksichtigen. Im Allgemeinen ist eine vollständige dreidimensionale Dosisverteilung der individuellen Strahlenquelle nicht bekannt, wenngleich dem Medizinphysiker die sich ausbildenden Isodosen bewusst sind. Basierend auf der zentralen Tiefendosiskurve und der vermessenen Tumorhöhe wird eine geeignete Dosierung gewählt und die Liegezeit des Applikators berechnet. Diese liegt in der Regel zwischen 2 bis 10 Tagen.
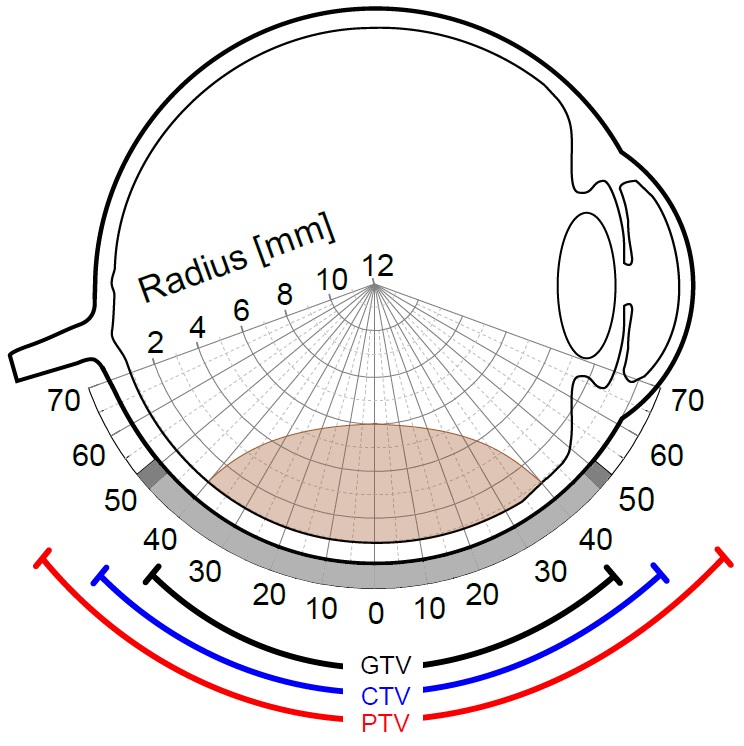
Das Sicherheitssaumkonzept
Die Definition von Sicherheitssäumen bei der Behandlung von Augentumoren mit Brachytherapie-Quellen ist aus zwei Gründen besonders wichtig. Zum einen stimmen die sichtbaren Tumorgrenzen nicht mit den histologisch nachweisbaren Tumorgrenzen überein. Zum anderen können bestimmte Fehlerquellen zu einer Unterdosierung führen. Sicherheitssäume sollen dafür sorgen, dass auch der Tumorrand und seine mikroskopischen Substrukturen eine ausreichende Dosis erhalten. Ebenso sollen Sicherheitssäume ausreichende Toleranzen am Apex gewährleisten. Gleichzeitig dürfen sie nicht zu groß gefasst werden, um gesundes Gewebe nicht unnötig mit einer hohen Dosis zu belasten. Letztendlich spiegelt die Definition von Sicherheitssäumen einen Kompromiss zwischen diesen beiden Maßgaben wider. Wenn man das Konzept der Teletherapie auf die Anwendung bei Augentumoren beziehen möchte, so stellt der sichtbar diagnostizierte Tumor das GTV (Gross Target Volume) dar. Hierzu muss ein Sicherheitssaum von 1-2 mm für mikroskopische Substrukturen addiert werden, das sogenannte CTV (Clinical Target Volume). Mögliche Unsicherheiten der Positionierung und der Behandlungsmethode werden durch das PTV (Planning Target Volume) aufgefangen. Die mit den diagnostischen Mitteln bestimmten Abmessungen des Tumors werden vom behandelnden Arzt ermittelt. Anhand dieser Daten wird über den zur Therapie zu verwendenden Applikatortypen entschieden, der die Abdeckung der beschriebenen Volumina gewährleistet.
Bei den verwendeten Quellen handelt es sich, wie schon erwähnt, um β−Strahler. Diese verfügen in lateraler wie auch in apikaler Richtung über steile Dosisgradienten. Das in Bezug auf die Schonung von nicht infiltriertem Gewebe positive Gradientenverhalten führt zu einer größeren Gefahr der Unterdosierung aufgrund der diskutierten Unsicherheiten. Daher werden Sicherheitssäume benötigt, die eine Umschließung des Zielvolumens gewährleisten.
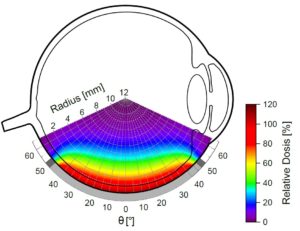
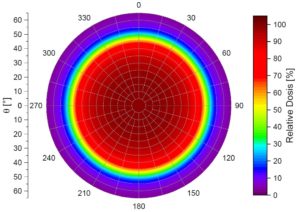
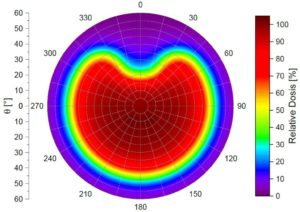
Dosisverteilung
Messungen zeigen im Vergleich zu Simulationen reale Oberflächendosisverteilungen. Dabei ist deutlich zu erkennen, dass die Homogenität der radioaktiven Belegung Einfluss auf den Verlauf der Isodosen hat
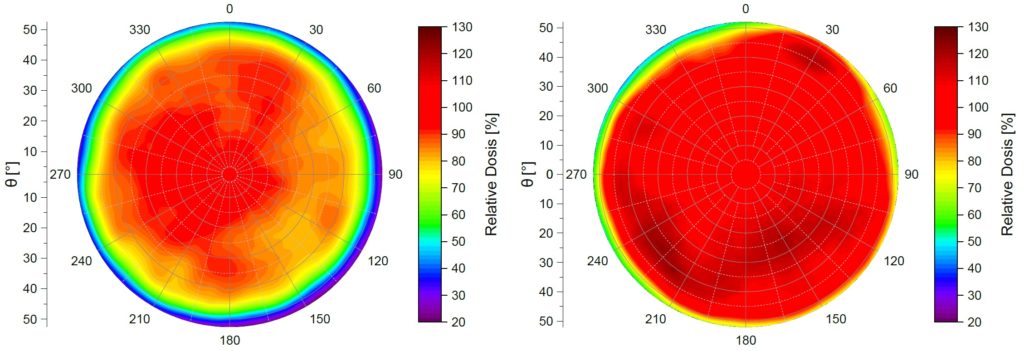
Bilder mit freundlicher Genehmigung von Hr. Stöckel.
Operation
Der operative Eingriff zum Einbringen des Applikators in die Augenhöhle kann unter lokaler Anästhesie oder Vollnarkose durchgeführt werden. In einem ersten Schritt muss die Bindehaut geöffnet werden, um einen Zugang zur Augenhöhle zu ermöglichen. Je nach Lage des Tumors werden an einigen Muskeln des Auges Fäden befestigt. Diese machen es dem Operationsassistenten möglich, das Auge in die vom Operateur gewünschte Position zu drehen. Zusätzlich kann es auch nötig sein, Muskeln zu durchtrennen, um die Platzierung des Applikators am Tumor möglich zu machen. Die Lokalisation des Tumors erfolgt mittels indirekter Ophthalmoskopie und transpupillärer und transskleraler Transillumination mit einem Diaphanoskop. Hierbei handelt es sich um eine Kaltlichtquelle, die in oder außerhalb der Augenhöhle so positioniert wird, dass der Tumor einen Schatten wirft und somit die lateralen Begrenzungen des Tumors sichtbar werden. Mit einem Stift können dann die Tumorbegrenzungen zuzüglich eines 1-2 mm breiten Saumes eingezeichnet werden. Diese Markierung dient später zur Orientierung bei der Positionierung. Anschließend wird der Applikator in die Augenhöhle eingebracht und entsprechend der Kennzeichnung auf der Sklera ausgerichtet. Die Position und Abdeckung des Tumors durch den Applikator wird anschließend mittels Diaphanoskop und Opthalmoskop kontrolliert. Nach erfolgter Positionierung wird der Applikator an den Halteösen durch Nähte auf der Sklera fixiert. Zusätzlich wird eine Naht über den Applikator gelegt, um einem Abklappen entgegenzuwirken. In einigen Augenzentren oder bei komplizierter Lage des Tumors wird zur Positionierung des Applikators ein nicht strahlender Dummy verwendet. Zusätzlich können die Position und auch ein mögliches Abklappen des Applikators durch Ultraschall überprüft werden. Nach erfolgtem Eingriff wird die Bindehaut wieder geschlossen. Der Applikator verbleibt für die berechnete Liegezeit in der Augenhöhle und deponiert im Tumor die nötige Dosis. Nach 2 bis 10 Tagen wird der Applikator in einem erneuten Eingriff wieder aus der Augenhöhle entnommen. Nach der Behandlung wird der Patient weiter betreut. In der Regel können nach 2 bis 3 Monaten die Auswirkungen der Bestrahlung auf den Tumor beobachtet werden. Eine Strahlennarbe bildet sich in diesen Regionen aus.
Weiterführende Literatur
- M. J. Jager, L. Desjardins, T. Kivelä, B. E. Damato. Current Concepts in Uveal Melanoma. Karger, 2012.
- D. Flühs, G. Anastassiou, J. Wening, W. Sauerwein, N. Bornfeld. The design and the do-simetry of bi-nuclide radioactive opthalmic applicators. Med. Phys., 31(6):1481–1488, 2004.
- E. Stöckel, M. Eichmann, D. Flühs, H. Sommer, E. Biewald, N. Bornfeld, B. Spaan, W. Sauerwein. Dose Distributions and Treatment Margins in Ocular Brachytherapy with 106Ru Eye Plaques. Ocul Oncol Pathol 2018 Sep;4(2):122-128