Inhaltsverzeichnis
In der klinischen Routine ist das Erstellen von Bestrahlungsplänen eine Hauptaufgabe des Medizinphysik-Experten. Früher wurde dazu unter anderem mit Tabellen gerechnet oder auf repräsentativen Transversal-Schichtbildern Isodosenverteilungen berechnet. Durch die Einführung von Computertomographien in der Strahlentherapie wurde die Bestrahlungsplanung revolutioniert. Auch der Einsatz von weiteren Modalitäten wie der Magnetresonanztomographie oder Positronen-Emissions-Tomographie ist möglich. Volumina können besser erfasst und Dosisverläufe genauer berechnet werden. Dazu werden moderne 3D-Bestrahlungsplanungsprogramme, dessen Funktionsumfang in den letzten Jahren immer erweitert und optimiert wurde, verwendet. Mittlerweile liefert jedes Bestrahlungsprogramm eine Berechnung der Dosiswerte in jedem einzelnen Punkt im Körper des Patienten. Zur Optimierung der Dosisverteilung hinsichtlich der Dosishomogenität und –konformität im Zielvolumen und der Schonung in umliegenden Risikoorgane, haben sich unterschiedliche Bestrahlungstechniken entwickelt.
Grundsätzlich wird zwischen der konventionelle 3D-Vorwärtsplanung und intensitätsmodulierte Bestrahlungstechnik wie IMRT und VMAT differenziert. Erst mithilfe intelligenter Software und gestiegenen Rechenkapazitäten sind die inversen Planungen überhaupt ermöglicht worden. Darüber hinaus hat sich auch eine Kleinfeld-Bestrahlungstechnik bei der hohe Dosiswerte sehr genau appliziert werden, die sogenannte Stereotaxie, etabliert. Die Grundvoraussetzungen für diese Technik wurden u.a. durch die Entwicklung feinerer Multi-Leaf-Kollimatoren und Messkammern für die Kleinfeld-Dosimetrie geschaffen. Informationen über die generelle Strahlentstehung und Feldformung sind auf den Seiten zum Aufbau und Funktionsprinzip des Linearbeschleunigers zu finden.
3D-Bestrahlungstechniken
Bei der konventionellen 3D-Bestrahlungsplanung werden größtenteils standarisierte zielvolumenspezifische Stehfeld-Anordnungen verwendet. Die Felder werden mithilfe der Blenden und Multi-Leaf-Kollimatoren an die Form des Zielvolumens angepasst. Die Anzahl der Einstrahlrichtungen liegt üblicherweise bei zwei bis sechs.
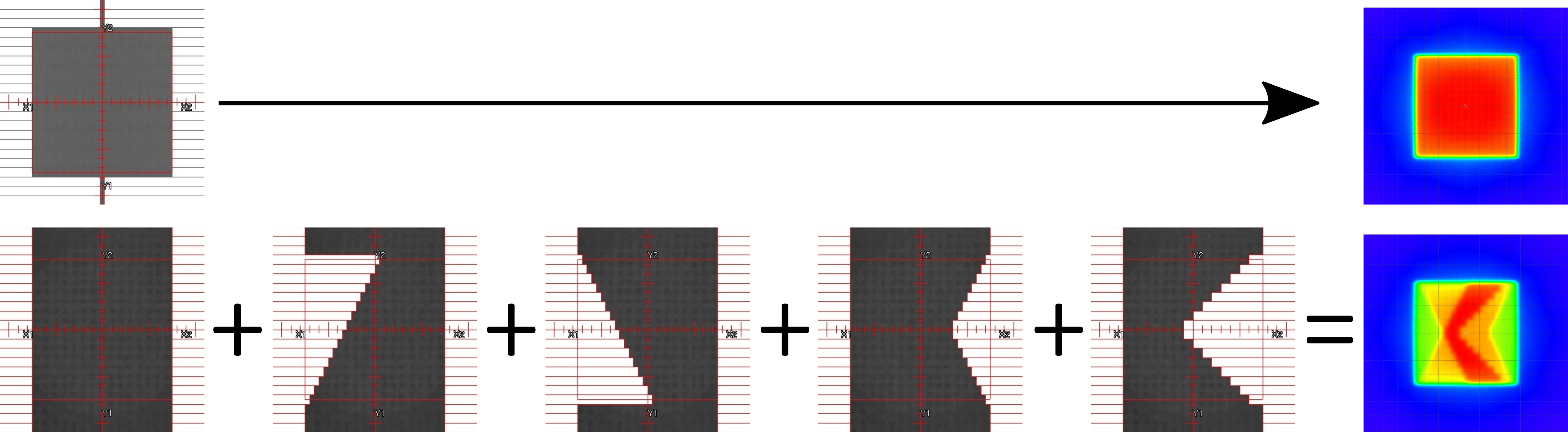
Für die Berechnung der Dosisverteilung, werden die Dosiskomponenten der jeweiligen Felder gemäß der Gewichtung addiert und anschließend normiert. Maßgebliche Parameter bilden dabei die Schwächung des Primärstrahls, die Feldgrößen (Blenden- und MLC-Formung) und die Strahlenfelddivergenz. Zusätzlich ist noch die Strahlenenergie, die einen Effekt auf die Tiefendosiskurve und das Wechselwirkungsverhalten hat, und natürlich die Patientenanatomie relevant. Zur Optimierung der Dosishomogenität im Zielvolumen kann der Einsatz von Keilfiltern notwendig sein.
Mittlerweile werden kaum noch Keilfelder verwendet. Dadurch, dass sie je nach Keilfilterwinkel sehr viel Strahlung absorbieren, haben Sie den Nachteil, dass zum einen sehr viel Streustrahlung entsteht und zum anderen die benötigten Monitor Einheiten (Photonenmenge) stark ansteigen. Bei der Verwendung von Energie im Bereich von über 10 MeV tritt zudem eine erhöhte Materialaktivierung auf. Eine elegantere Lösung bietet die sogenannte Field-in-Field-Technik, die im Grunde einer vorwärtsgeplanten intensitätsmodulierten Planung entspricht. Dabei wird, anstelle eines Keils, ein weiteres Feld mit den gleichen Parametern (Einstrahlwinkel, Energie usw.) angelegt und der über-/unterdosierte Bereich ausgeblockt/aufgesättigt.
Halbfeld-Technik
Eine weitere hilfreiche Technik bei der 3D-Vorwärtsplanung bietet die sogenannte Halbfeld-Technik. Dabei wird durch das Zuziehen einer Feldblende bis zum Isozentrum die Strahldivergenz in eine Richtung unterbunden.
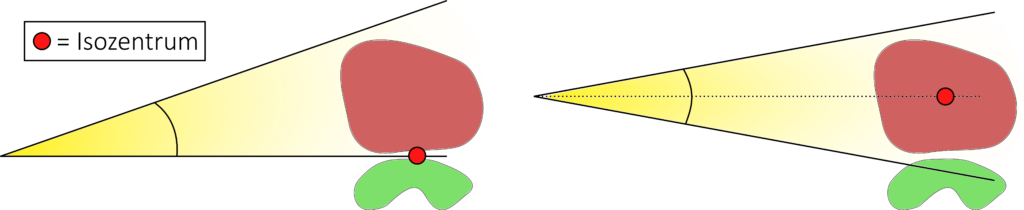
Diese Technik macht insbesondere dann Sinn, wenn das Isozentrum genau auf die Grenze zwischen Zielvolumen und Risikoorgan gelegt werden kann oder eine Aufteilung des Zielvolumens notwendig ist. Ein typisches Beispiel für die Halbfeldtechnik bei der Trennung zwischen Zielvolumen und Risikoorgan ist die Bestrahlung von Mammakarzinomen. Das Isozentrum wird in der Regel zwischen die zu bestrahlende Brust und den gleichseitigen Lungenflügel in die Nähe der Rippen gelegt. Auch der Bestrahlung eines Ganzhirns wird zur Schonung der Linsen das Isozentrum direkt hinter die Augen gesetzt.
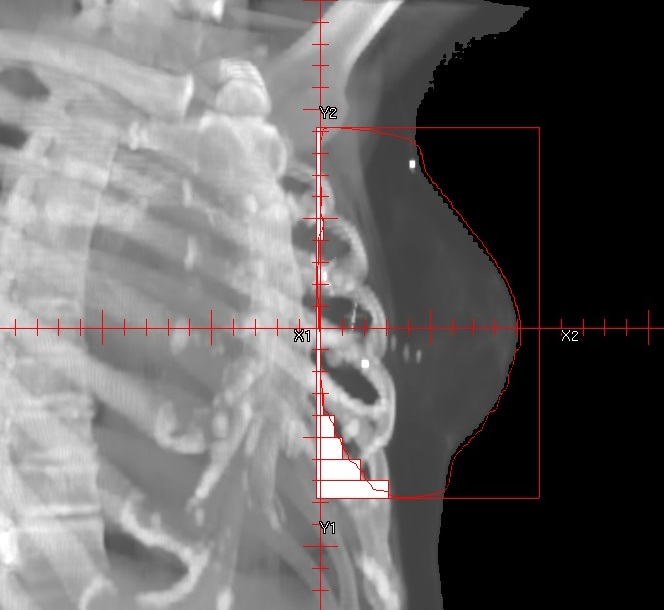
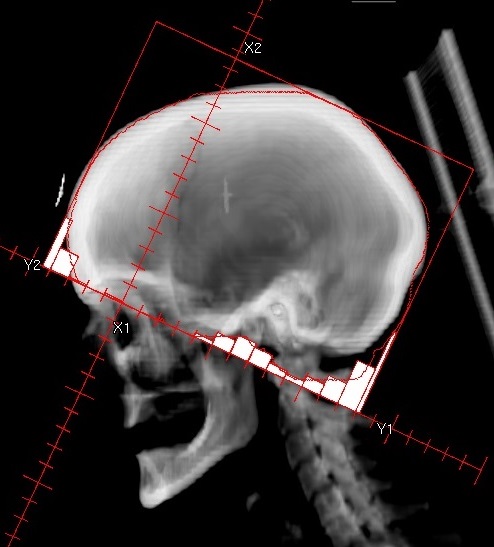
Eine Aufteilung ist auch dann sinnvoll, wenn das Zielvolumen seine Form in cranial-caudaler Richtung stark ändert und andere Einstrahlrichtungen notwendig sind. Die Technik ermöglicht, dass für den unteren und oberen Teil des Zielvolumens unterschiedliche Feldrichtungen verwendet werden können, ohne dass die Dosisbeiträge die jeweils andere Dosisverteilung stark beeinflussen.
Intensitätsmodulierte Bestrahlungstechniken
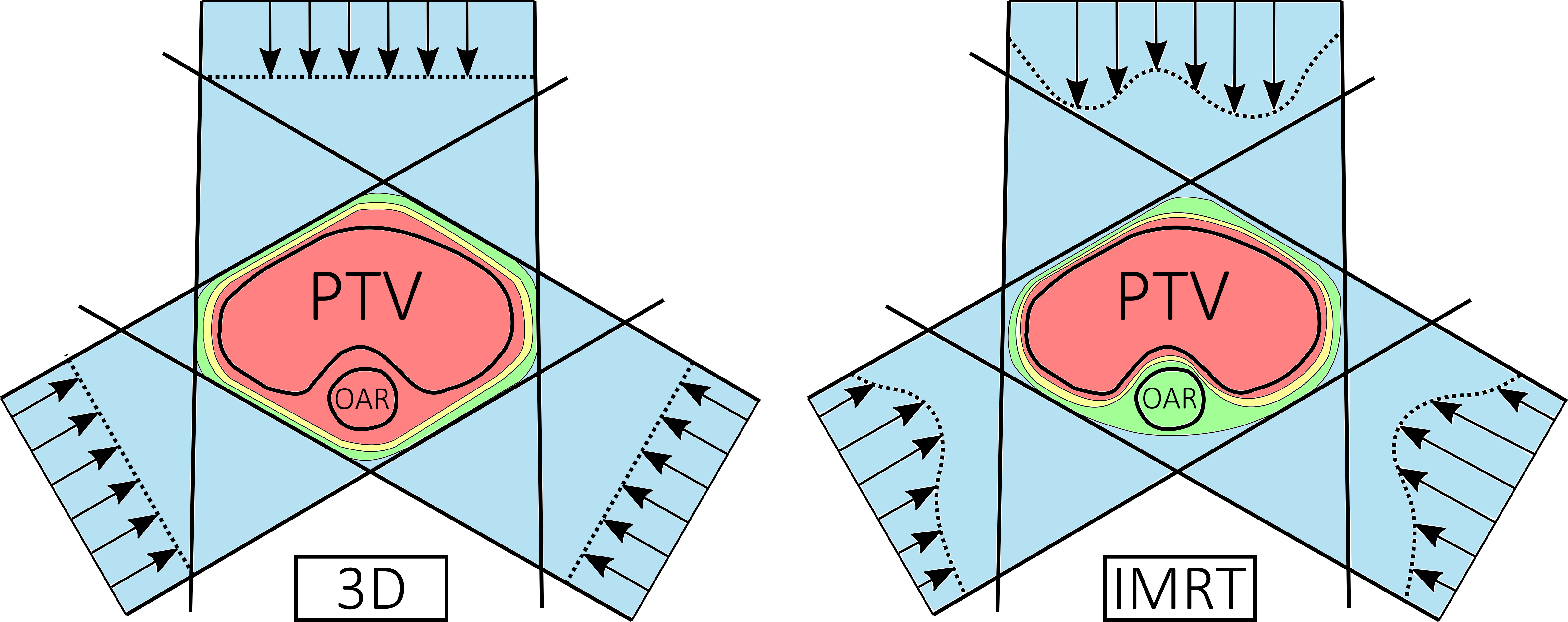
Im Gegensatz zur konventionellen 3D-konformalen Bestrahlungsplanung werden anstelle von homogenen Stehfeldern, intensitätsgewichtete Strahlenfelder verwendet. Generell wird zwischen der IMRT- (Intensity Modulated Radiation Therapy) und der VMAT-Technik (Volumetric Modulated Arc Therapy) unterschieden, wobei die IMRT-Technik entweder mithilfe der sogenannten Step-and-Shoot- oder der Sliding-Window-Technik durchgeführt werden kann.
Bei der IMRT-Technik besteht ein Feld aus mehreren Subfeldern, die zusammen ein intensitätsgewichtetes Strahlenfeld bilden. Diese Subfelder werden automatisch nacheinander entweder mit kurzen Strahlunterbrechungen (Step-and-Shoot) oder ununterbrochen unter ständiger Bewegung der Multi-Leaf-Kollimatoren abgestrahlt. Die planare Dosisverteilung eines Beams ist folglich nicht glatt, sondern je nach Anforderung „gebirgsähnlich“ geformt.
Durch das Verwenden mehrerer Segmente pro Einstrahlrichtung sind Dosisverteilungen eines Strahlenfeldes nicht mehr homogen. Dadurch lassen sich bereits mit wenigen Feldern hochkonformale Pläne erzeugen und Risikoorgane besser schonen. Beispielhaft hier ist ein Plan mit drei Feldern dargestellt, der dieses Prinzip veranschaulichen soll.
Da das Anlegen von Subfeldern und deren Einfluss aufeinander zu komplex wäre um einen Bestrahlungsplan wie einen 3D-Vorwärtsplan zu erstellen, werden intensitätsmodulierte Pläne „invers“ geplant. Der Medizinphysik-Experte gibt lediglich die Rahmenbedingungen, wie das Isozentrum, Feld- und Segmentanzahl, Einstrahlrichtungen, minimale Segment-MU und –größe sowie die Dosierung an. Zusätzlich werden Ziele (Optimization Goals / Objectives) definiert, die von der Software bei der Berechnung des Plans berücksichtigt werden. Das sind zum einen die Dosierungsvorgaben für das/die jeweilige/n Zielvolumen und zum anderen Dosisbegrenzungen für die umliegenden Risikoorgane. Diese Begrenzungen können sich z.B. auf die maximale Dosis, mittlere Dosis oder die maximale Dosis pro relatives Volumen beziehen. Da aufgrund des begrenzten Dosisgradienten oder sogar Überlappungen nicht immer alle Kriterien erfüllt werden können, müssen die Vorgaben je nach Vorgabe des Arztes gewichtet werden.
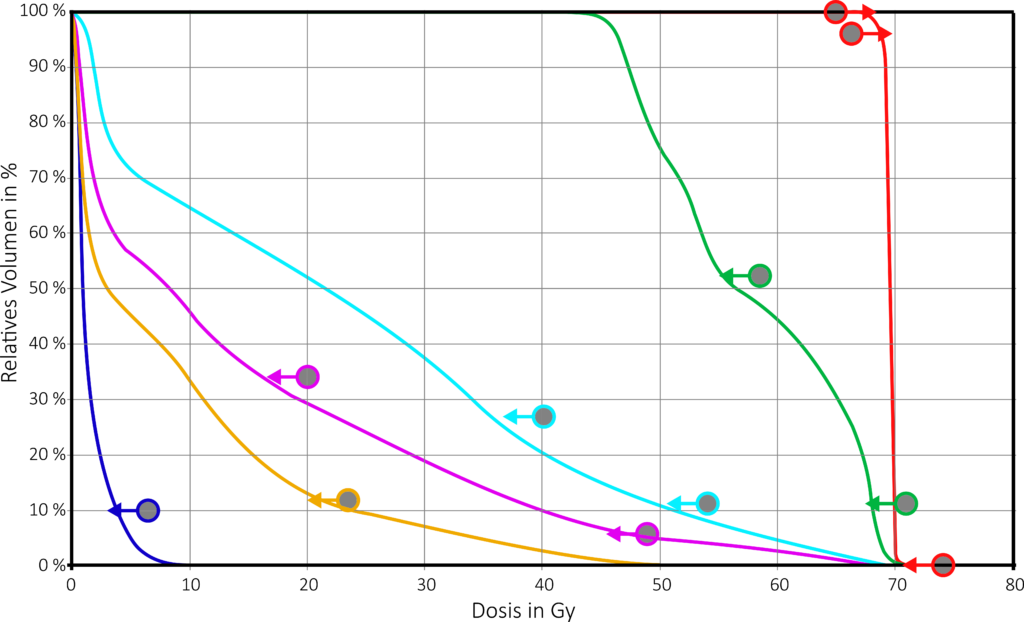
Dieses Funktionsprinzip ermöglicht eine hochkonformale Umschließung des Zielvolumens mit der gewünschten Dosis oder im Falle einer simultanen Boostbestrahlung, unterschiedliche Dosisstufen im Gewebe. So können auch komplex-geformte Zielvolumen homogen bestrahlt werden und Risikoorgane besser geschont werden. Insbesondere wenn Risikoorgane von dem zu bestrahlenden Volumen teil- oder vollständig umschlossen sind, gelingt eine Schonung deutlich besser als mit der 3D-konformalen Bestrahlungstechnik. Aus diesem Grund zeichnet sich diese Technik speziell bei Erkrankungen wie HNO-Tumoren, bei denen Risikoorgane wie das Rückenmark oder die Speicheldrüsen teilweise vom Tumor umschlossen sind, aus.
Nachteile der intensitätsmodulierten Bestrahlungstechnik
Neben der scheinbaren Überlegenheit dieser Bestrahlungstechnik hat sie allerdings auch einige Nachteile. Da in der Regel mehr Einstrahlrichtungen und keine opponierenden (gegenüberliegenden) Bestrahlungsfelder verwendet werden, steigt die Niedrigdosisbelastung im Normalgewebe. Dieser Effekt wird durch eine steigende Anzahl an Monitor Einheiten zusätzlich verstärkt. Im Gegensatz zur 3D-konformalen Planung werden anstelle eines großen homogenes Feldes viele kleine Subfelder verwendet. Diese besitzen einen kleineren Output-Faktor, wodurch die benötigte Photonenmenge und damit die Streustrahlung im Patienten steigt.
Ein weiterer Nachteil ist die Anfälligkeit gegenüber Lagerungsungenauigkeiten und Volumenänderungen. Dadurch, dass Dosisgradienten steiler und die Konformität höher sind, schwindet die Robustheit der 3D-Vorwärtsplanung. Aus diesem Grund müssen die Anforderungen an die Lagerung und die Volumenkontrolle an die Bestrahlungstechnik angepasst werden. Bei Prostatakarzinomen kann dies z.B. in Form von Kontrollen der Blasenfüllung erfolgen.
Der letzte Nachteil der IMRT-Technik ist die Bestrahlungszeit. Dadurch, dass nicht einzelne Stehfelder, sondern teilweise bis zu 100 Subsegmente angefahren werden müssen, können die Bestrahlungszeiten trotz moderner Beschleuniger bei bis zu 15 Minuten liegen. Neben dem offensichtlichen wirtschaftlichen Nachteil, sind insbesondere für palliative Patienten mit schmerzhaften Knochenmetastasen aber auch Kleinkinder die langen Liegezeiten ein Problem.
VMAT
Die VMAT ist eine Weiterentwicklung der IMRT-Technik, bei der die Gantry nicht statisch steht, sondern während der Bestrahlung dynamisch um den Patienten rotiert. Dabei wird die Feldgröße, durch die Blenden und die Multi-Leaf-Kollimatoren kontinuierlich an das zu bestrahlende Volumen und die zu schonenden Risikoorgane angepasst. Auch die Rotationsgeschwindigkeit und die Dosisleistung werden individuell angepasst um aus bestimmten Einstrahlrichtungen mehr oder weniger Dosis zu applizieren. Ähnlich wie bei der IMRT-Bestrahlungstechnik werden bei der Planung nur die Rahmenbedingungen definiert. Anstelle von statischen Feldern werden hier allerdings die Anzahl der Rotationsbestrahlungen, der jeweilige Winkelbereich und ggf. die maximale Bestrahlungsdauer definiert.
Ein offensichtlicher Vorteil dieser Bestrahlungstechnik ist die Geschwindigkeit der Dosisapplikation. Typische Bestrahlungsdauern für Rotationsbestrahlungen liegen bei 2 Minuten. Das ist für den Patienten sehr angenehm. Darüber hinaus ist der Effekt von Organbewegungen reduziert und auch die Wahrscheinlichkeit, dass der Patient während der Bestrahlung seine Position verändert, ist geringer.
Seit 2008 bieten die meisten Linearbeschleuniger diese Bestrahlungstechniken an.
Atemgating / Tumortracking
Zum Erreichen des Therapieziels müssen möglichst alle Tumorzellen irreparabel beschädigt werden und umliegendes Normalgewebe bestmöglich geschont werden. Der Erfolgt hängt dabei maßgeblich von der Bildgebung, Konturierung, Planung und letztendlich einer genauen Bestrahlung ab.
Probleme ohne Atemating / Tumortracking
Die Basis der Bestrahlungsplanung ist eine dreidimensionale Computertomographie, die eine statische Aufnahme der Patientenanatomie liefert. Durch Organbewegungen, wie z.B. der Atmung, verändert sich die Lage von Organen jedoch ständig. Die Folge kann eine abweichende Patientenanatomie während der Bestrahlung sein, sodass das Zielvolumen aus den Bestrahlungsfeldern rauswandert oder ursprünglich ausgesparte Risikoorgane bestrahlt werden. Insbesondere bei Zielvolumen die in oder um die Lunge lokalisiert sind, spielt dieser Effekt eine entscheidende Rolle. Um diesen Bewegungen gerecht zu werden hat die ICRU eine Leitlinie verfasst (ICRU Report 83: Prescribing, Recording, and Reporting Photon-Beam Intensity-Modulated Radiation Therapy) die Sicherheitssäume definiert. Diese sollen gewährleisten, dass alle internen und externen Einflüsse auf die Tumorlage und –form in der Größe des letztlich bestrahlten Zielvolumens (PTV) berücksichtigt werden. Bei Lungentumoren werden zur Umsetzung dieses Konzepts üblicherweise drei Computertomographien, je eins in Inspiration, Exspiration und Atemmittellage gefahren und miteinander fusioniert. In der Fusion ist der Verlauf der Lage und Größe des Tumors (GTV) in jeder Atemlage nachvollziehbar. Die Summe der Tumorvolumina aus allen Atemphasen bildet das finale GTV und damit die Grundlage für das CTV und PTV. Die Bewegungen eines Lungentumors ist besonders nach superior-inferior und anterior-posterior ausgeprägt, insbesondere, wenn er sich im unteren Lungenlappen befindet. So sind Positionsänderungen von über 10 Millimeter keine Seltenheit.
Offensichtlich geht dieses Konzept zu Lasten des umliegenden Normalgewebes, da die Feldgrößen der Bestrahlungsfelder erhöht werden müssen. Da die Größe die Sicherheitssäume direkt mit der Belastung des gesunden Gewebes korreliert, ist die Minimierung der Unsicherheiten zur Eindämmung von Nebenwirkungen erstrebenswert. Hinsichtlich der technischen Möglichkeiten (Linearbeschleuniger, Lagerung, Bildkontrollen) sind die Unsicherheiten in den letzten Jahren immer kleiner geworden. Physiologische Prozesse lassen sich jedoch im Hinblick auf die Organbewegung nur eher schlecht optimieren.
Methoden der Atemkorrelation
Die o.g. Probleme können mithilfe von zwei unterschiedlichen Methoden zur bewegungskorrelierten Bestrahlung gelöst werden. Dem Atemgating oder dem Tumortracking. Während beim Atemgating der Tumor nur während einer bestimmten Atemphase bestrahlt wird, ist beim Tumortracking durch eine kontinuierliche Blenden- und MLC-Anpassung eine ununterbrochene Bestrahlung möglich.
Für das Atemgating kann entweder die Luft angehalten („Breath-Hold“-Technik) oder ein Gating-Fenster („Gating“-Technik) definiert werden. Recht populär ist die sogenannte „Deep Inspiration Breath Hold“-Technik (DIBH), bei der eine Computertomographie unter maximaler Inspiration gefahren wird. Aus der dynamischen Atembewegung wird so eine statische Situation geschaffen. Bei der Gating-Technik wird ebenfalls nur in einer Atemphase gestrahlt, allerdings wird dabei die Interlock-Schleife des Linearbeschleunigers mit einem bestimmten Abschnitt des Atemzyklus verknüpft. Diese Methodik hat den Vorteil, dass eine flache Atmung oder kurze Zeiten, in denen die Luft angehalten werden kann, keine limitierenden Faktor darstellen. Ein Nachteil der jedoch beide Bestrahlungstechniken betrifft ist die Bestrahlungsdauer, die sich aufgrund der Einschränkung auf eine Atemphase deutlich erhöht.
Die beiden Nachteile des Gating treten bei der 4D-Bestrahlung, dem Tumortracking, nicht auf. Hier werden die Bestrahlungsparameter ständig an die Lage und Größe des PTV angepasst. Basis der Bestrahlungsplanung ist keine statische 3D-Computertomographie, sondern ein 4D-Datensatz in dem die Bildinformation direkt an den Atemzyklus gekoppelt ist. Im Gegensatz zur konventionellen 3D-Planung wird im Planungsprozess eine Referenzatemphase gewählt, in die Konturierung durchgeführt wird. Anschließend werden die Konturen auf die restlichen Atemphasen übertragen und geprüft. Dieser Prozess wiederholt sich analog für die Bestrahlungsplanung.
Während des Planungs-CT und auch während der Bestrahlung muss sichergestellt sein, dass die Tumorlage bekannt ist. Relevant sind die Position des Brustkorbs und die Zeit, die der Patient die Luft anhalten kann. Die Position des Brustkorbs kann über ein bestimmtes Atemvolumen, das mithilfe eines Spirometers gemessen wird. Nach Erreichen des gewünschten Atemvolumens wird automatisch eine technische Atemsperre aktiviert. Alternativ kann mithilfe die Brustkorbhöhe mithilfe eines Infrarotwürfels, der auf den Brustkorb des Patienten gelegt und mithilfe einer Kamera erkannt und wird, verfolgt. Dieses Verfahren lässt sich analog unter Verwendung eines Brustgurtes mit integrierten Dehnungssensoren durchführen. Seit einiger Zeit existiert auch die Möglichkeit die Patientenoberfläche zu registrieren und abweichende Positionen farblich darzustellen. Dafür wird eine natürliche Lichtquelle auf den Patienten projiziert und mit einer Stereokamera analysiert (SBRT).