Inhaltsverzeichnis
Beim Afterloader handelt es sich um ein Nachladesystem der HDR-Brachytherapie (High-Dose-Rate), bei der üblicherweise eine γ-Strahlungsquelle temporär über einen Führungsschlauch in die zu bestrahlende Körperregion gefahren wird. Die Quellenapplikation kann entweder …
- … interstitiell, durch Implantation umschlossener Strahler oder unter Verwendung von Hohlnadeln direkt in das Tumorbett (z. B. in Form einer Prostataspickung),
- … intrakavitär, durch Einführen umschlossener Strahler unter Verwendung starrer Applikatoren (z. B. Edelstahl, Plexiglas) in natürliche Körperöffnungen oder präformierte Körperhöhlen (z. B. in die Gebärmutter),
- … intraluminal, durch Einführen umschlossener Strahler unter Verwendung flexibler Plastikelemente (ggf. dilatierbar zur Distanzierung) durch eine künstliche Öffnung in ein natürliches Hohlorgan oder eine präformierte Körperhöhle (z.B. in den Ösophagus, die Trachea oder den Bronchus),
- … intravaskulär (endovasal), innerhalb eines Blutgefäßes
- … oder über die Kontakttherapie durch das Auflegen von Flabs / Moulagen auf die innere oder äußere Körperoberfläche (z. B. Haut)
erfolgen. Weiter wird je nach Dosisleistung des verwendeten Nuklids gemäß DIN 6814-8 unterschieden. High-Dose-Rate Nuklide (> 12 Gy/h) werden beim Afterloading verwendet, Low-Dose-Rate Nuklide (< 2 Gy/h) bei der (dauerhaften) Seed-Implantation.
Allgemeine Dosiskonzepte
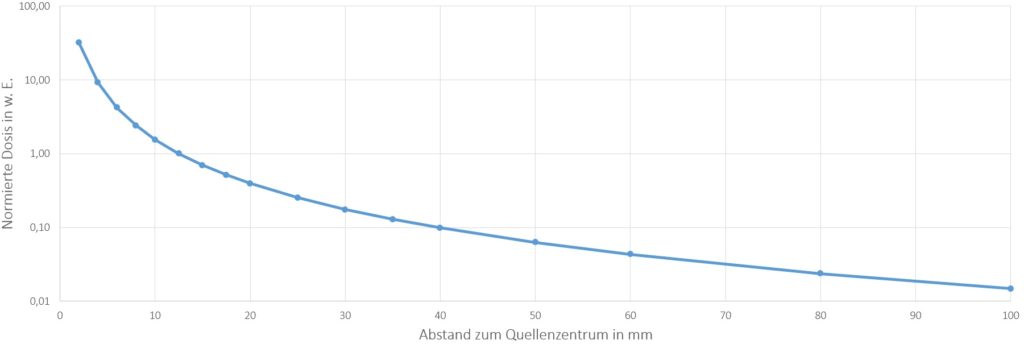
Der offensichtliche Vorteil der Brachytherapie gegenüber der Teletherapie besteht in den steilen Dosisgradienten entsprechend des Abstand-Quadrat-Gesetzes, wodurch hohe Dosiswerte bei gleichzeitiger Schonung des umliegenden Normalgewebes, appliziert werden können. Einher mit diesem Vorteil geht der Nachteil, dass nur Tumore mit kleinem Durchmesser behandelt werden können und Dosis-Hot-Spots sowie Inhomogenitäten bei geringen Lagerungsungenauigkeiten auftreten können. Damit das Tumorvolumen in der Peripherie eine ausreichend hohe Strahlendosis erfährt, wird die Brachytherapie oftmals als Boostbestrahlung zusätzlich zur Teletherapie angewendet. Die räumliche Dosisverteilung ergibt sich aus quellenspezifischen Dosisparametern sowie den Haltepositionen und –zeiten der Strahlungsquelle. Trotz der Unterschiede zur perkutanen Strahlentherapie stammen viele Empfehlungen zur Dosis- und Volumenspezifikation aus dem zugehörigen ICRU-Report 50 bzw. der Vorversion ICRU-Report 29 zur Teletherapie (GTV, CTV, PTV, TV, IV).
Generell wird bei der Dosisspezifikation der Brachytherapie zwischen applikator- oder zielvolumenspezifischer Dosierung unterschieden. Die Dosierungskonzepte sollen die Reproduktion und Vergleichbarkeit klinischer Ergebnisse ermöglichen. In der Brachytherapie erschwert der steile Gradient die Dosierung, weshalb aus physikalischer Sicht ein Mindestabstand zur Referenzdosis Sinn macht. Bei zu kleinen Abstände würden sich statistische und systematische Lagerungsunsicherheiten enorm auf die Dosis auswirken. Bei simplen Applikatorgeometrien wird eine Dosisangabe in mindestens 1 cm radialer Entfernung von der Applikatorachse empfohlen. Bei zielvolumenorientierten Angaben wird die Referenzdosis (unter Berücksichtigung der Erfüllung der applikatorspezifischen Dosierung) üblicherweise in einer Gewebetiefe von 0,5 cm definiert. Sehr spezifische Applikatorgeometrien oder Anwendungen erfordern individuelle Dosierungskonzepte.
Die Hauptbestandteile eines Afterloaders sind u.a.:
Radioaktive Quelle
Dummy-Quelle
Antriebseinheiten
Endschalter
Ausfahrwegkontrolle
Ausfahranschlusskontrolle
Indexer
Abschirmung
Handkurbel


Hersteller sind unter anderem Varian Medical Systems, Elekta, Sauerwein Isotopen, Eckert & Ziegler BEBIG GmbH, Nucletron B.V.
Iridium-192
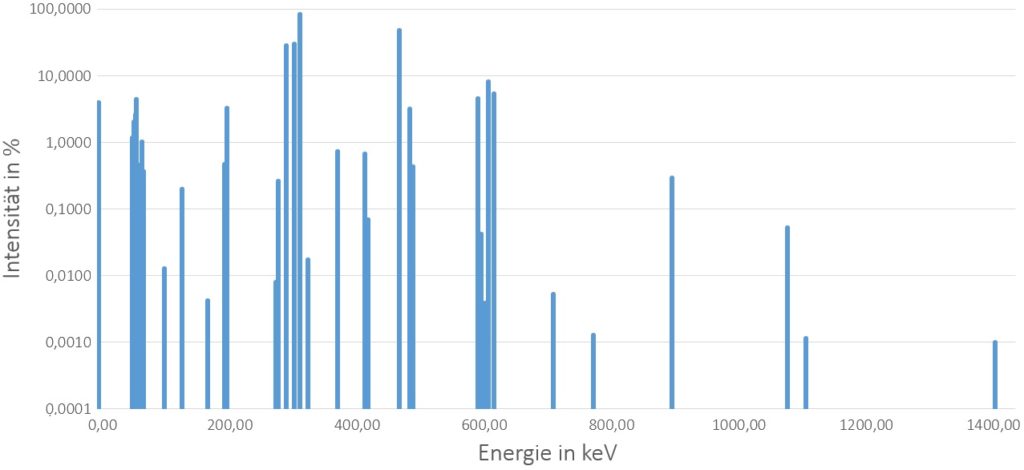
Iridium-192 ist aufgrund seiner hohen spezifischen Aktivität, der geringen Kosten, seines Energiespektrums und der Halbwertszeit die meist genutzte Afterloading-Strahlenquelle. Die Halbwertszeit von Iridium beträgt 73,801 Tage, weshalb der Quellenwechsel in den meisten Kliniken drei- bis viermal pro Jahr durchgeführt wird. Iridium-192 zerfällt als Gammastrahler zu Platin-192 (95,24 %) und unter Elektroneneinfang zu Osmium-192 (4,76 %). Das Radionuklid liegt in pulverisierter Form in Edelstahlkapseln, z. B. aus AISI316L, vor. Die Kapsel dient einerseits dem Schutz der Quelle, während sie in den Applikator fährt und absorbiert andererseits die für die klinische Bestrahlung nicht relevanten Elektronen. Der Draht, mithilfe dessen die Quelle zu der zu bestrahlenden Region fährt, ist ebenfalls aus Edelstahl, z. B. aus AISI304, gefertigt. Die mittlere Energie der Iridium-192-Strahlenquelle beträgt 346,9 keV.
Sehr viele Daten zu Brachytherapie-Strahlenquellen lassen sich sehr schön in Excel-Tabellen dargestellt, auf der Internetpräsenz der Universität Valencia finden. Angaben zur Zusammensetzung der Edelstähle für die sehr häufig verwendete GammaMed Plus Quelle von Varian, lassen sich zum Beispiel in finden.
Nachfolgend die Tiefendosiskurve und das Energiespektrum einer GammaMed Plus Iridium-192 Strahlungsquelle.
Intrakavitäres Afterloading
Bei der intrakavitären Brachytherapie werden umschlossene Strahlenquellen unter Verwendung starrer oder flexibler Applikatoren (z. B. Edelstahl, Plexiglas) in natürliche Körperöffnung oder präformierte Körperhöhlen gefahren. Zielvolumen sind die Gebärmutter (Corpus uteri), der Gebärmutterhals (Zervix, Cervix), die Gebärmutterschleimhaut (Endometrium), die Vagina, das Rektum, die Speiseröhre (Ösophagus), die Luftröhre (Trachea), die Luftwege (Bronchus) und der Nasenrachen(raum) (Nasopharynx).
Empfohlene Volumen- & Dosisspezifikationen für intrakavitäre Brachytherapie können dem gleichnamigen ICRU-Report 38 aus dem Jahre 1985 entnommen werden. Der Report handelt insbesondere von der Therapie des Zervix- und nur bedingt vom Endometrium-Karzinom. Darüber hinaus existiert seit 2016 der ICRU-Report 89, der vom Verschreiben, Dokumentieren und Berichten der Brachytherapie des Zervix-Karzinoms handelt.
Zervix-Karzinome
Die Dosierung erfolgt unter Verwendung zweier Referenzpunkte, Punkt A (kurz: 2cm lateral und kranial der Portio) und Punkt B (kurz: 3cm lateral von Punkt A) gemäß ICRU-Report 38 und DIN 6827-3. Die Punkte beruhen auf dem Manchester-System (Paterson 1948, Meredith 1967), das neben dem Stockholm- (Kottmeier 1964, Walstam 1954),) und Pariser-System (Lamarque et al. 1951, Pierquin1964), die Grundlage für die Anfänge der Brachytherapie-Behandlung des Zervix-Karzinom im letzten Jahrhundert gebildet hat. Genau liegt der Punkt A 2 cm lateral vom zentralen Uteruskanal und 2 cm kranial von der Mukosamembran. Punkt B befindet sich 5 cm lateral von A.
Die Namen der Therapie stammen aus den Herkunftsstädten Manchester, Stockholm und Paris. Die Dosierung erfolgt meistens applikatororientiert in 5 mm von der Oberfläche bzw. 5 mm Gewebstiefe. Üblich sind Dosen zwischen 6 und 8 Gy bei 2 bis 6 Fraktionen. Limitierender Faktor ist vor allem das Rektum, seltener die Blase.
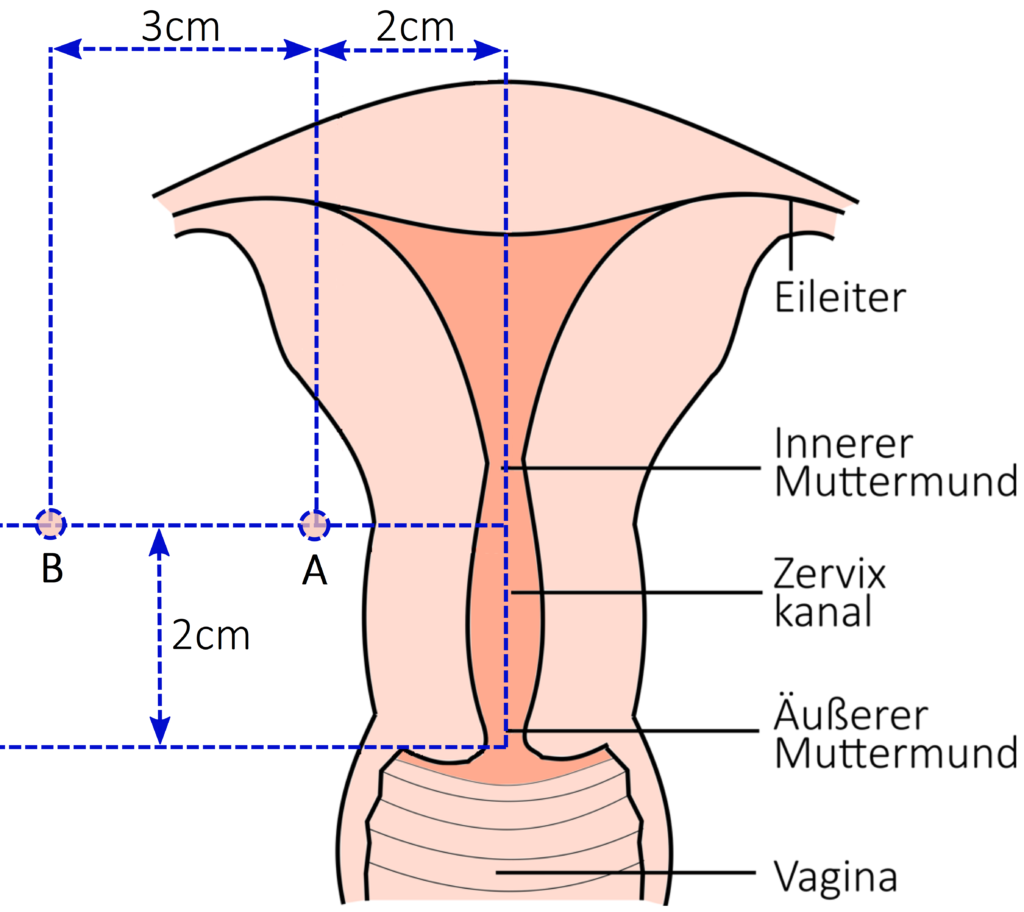
Die Punkte A & B des Manchester Systems stammen aus einer Zeit, in der die Möglichkeiten der medizinschen Bildgebung begrenzt waren. Demenstprechend wurden keine keine individuellen Anatomien berücksichtigt und sollten daher eher in der heutigen Zeit eher als grobe Orientierung dienen. Zum Vergleich mit ähnliche klinischen Fällen sind sie dennoch gut geeignet.
Die Kontrolle der Dosis erfolgt wie bei fast allen Beckenbestrahlungen in der Regel mit einer Rektum– (und Blasensonde). Die Rektumsonde ist einfacher zu handhaben und die Nebenwirkungen sind deutlich geringer.
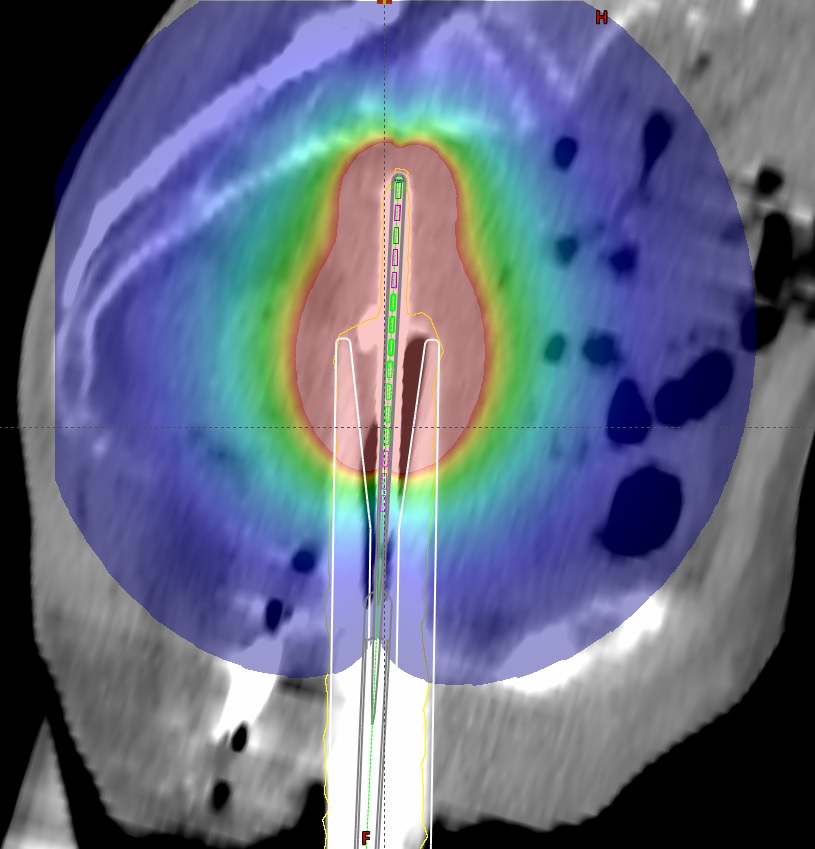
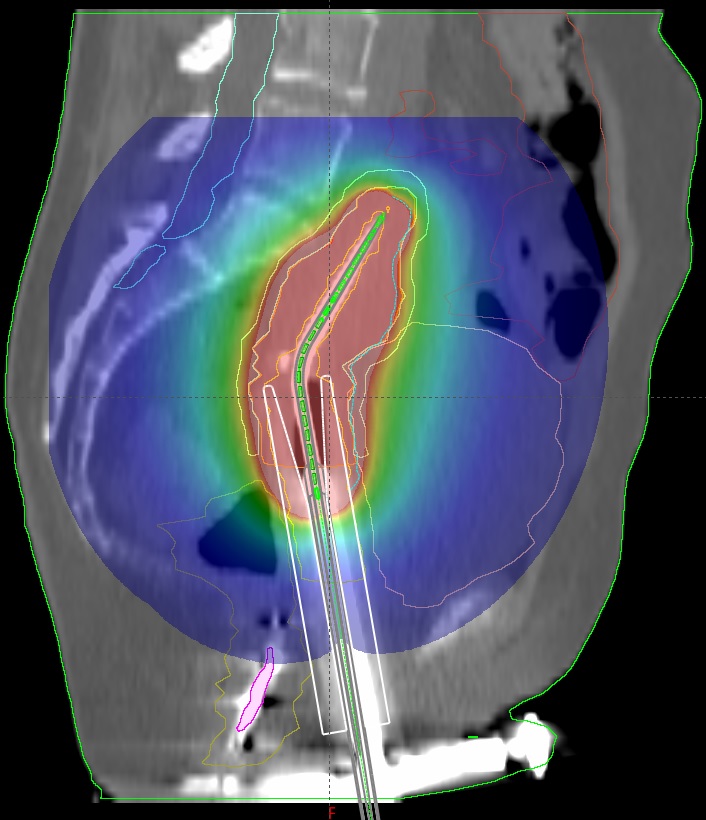
Bronchiale und tracheale Brachytherapie
Die endobronchiale und –tracheale Brachytherpiae erfolgt in den häufigsten Fällen unter lokaler Anästhesie und Sedierung. Die Anwendung eignet sich insbesondere bei kleinen inoperablen Zielvolumen zum Erhalt des Bronchiallumens. Wie bei vielen Brachytherapiemethoden kann die Anwendung auch neoadjuvant erfolgen, um den Tumor auf eine operable Größe zu verkleinern oder in Kombination mit der Teletherapie als Boostbestrahlung. Zur Definition des Zielvolumens erfolgt eine Bildgebung unter Verwendung eines flexiblen Endoskops, das entweder oral oder nasal (nur bei schmalen Applikatoren) eingeführt wird. Zur Lokalisation des Tumors bei Therapiebeginn wird eine Endoskopie, während der Patient auf dem Rücken oder der (linken) Seiten liegt, durchgeführt. Dabei wird die Distanz von den Zähnen bis zum Tumor mithilfe des Endoskops ermittelt und mit den Ergebnissen der Diagnostik verglichen. Anschließend wird ein dünner flexibler Führungsdraht durch den Arbeitskanal des Endoskops soweit geschoben, sodass es die Distanz bis zum zu bestrahlenden Gewebe weit überschreitet. Das Endoskop wird entfernt und der Applikator wird entlang des Führungsdrahtes und mithilfe der zuvor ermittelten Entfernungen platziert. Zuletzt wird ein röntgendichter Markierungsdraht in den Applikator geführt um die Lage des gelegten Applikators anhand zweier orthogonaler Röntgenaufnahmen (z. B. mit einem C-Bogen) zu kontrollieren. Als Referenz können Marker aus Röntgenaufnahmen, Clips oder anatomische Kennpunkte verwendet werden.
Abweichend vom Standarddosiskonzept wird eine Dosierung von 5 Gy in 10 mm Tiefe (ausgehend von der Längsachse des Applikators) bei einer Gesamtdosis von 15-20 Gy empfohlen (D. Latz et al. 1990, Aygun C et al. 1992). Bei sichtbaren Strahlenreaktionen der Bronchuswand kann die Einzeldosis gegebenenfalls reduziert werden.
Um das Auftreten von Dosis-Hot-Spots so gering wie möglich zu halten, existieren, wie auch bei der endovasalen Brachytherapie, Möglichkeiten, den Applikator zentral mit konstantem Abstand zur Bronchuswand zu lagern. Dabei behilflich sind kleine Abstandshalter, die im Gegensatz zu Ballonapplikatoren den Vorteil haben, dass die Atmung des Patienten nicht behindert wird (Centering Intraluminal Applicator, Fritz Adjustable Applicator). Applikatoren ohne Abstandshalter sind hingegen einfacher zu lagern, da sie über im Gegensatz zu den Zentralapplikatoren durch den Arbeitskanal eines üblichen Endoskops zum Zielvolumen gefahren werden können. Applikatoren mit Abstandshalter hingegen müssen unter Anwendung der Seldinger-Methode platziert werden. Neben dem üblichen Monitoring durch eine Kamera und ein Ortdosimeter wird während der Behandlung mit einem Elektrokadiogramm (EKG) die Herzfrequenz und der Herzrhythmus sowie der Blutdruck und die Sauerstoffkonzentration des Patienten durchgehend überwacht. (
Intraluminales Afterloading
Bei der intraluminalen Brachytherapie werden umschlossene Strahlenquellen durch künstliche Öffnungen in Hohlorganen oder präformierte Körperhöhlen gefahren. Zielvolumen sind der Gallengang oder die männliche Harnröhre (Urethra).
Aufgrund möglicher gekrümmter Formen ergeben sich auf der Krümmungsinnenseite bei kleineren Radien Überdosierungen, die ab einem bestimmten Grad berücksichtigt werden müssen. Dasselbe gilt für die entsprechende Unterdosierung auf der Gegen- bzw. Krümmungsaußenseite.
Die Referenzdosis wird sowohl im Abstand von 1 cm senkrecht zur Zentralachse des Applikators als auch in 0,5 cm Gewebstiefe, ebenfalls senkrecht zur Applikatorachse definiert.
MammoSite-Ballons
Der MammoSite-Applikator ist ein füllbarer sphärischer Silikonballon, der intraoperativ in der Kavität des entfernten Tumors platziert wird. Der wird Ballon wird mit einem Gemisch aus isotoner Kochsalzlösung 0,9 % und Kontrastmittel (z. B. in einem Verhältnis von 10:1) gefüllt. Das iodhaltige Kontrastmittel hebt den Ballon auf den CT-Bildern vom Brustgewebe ab, sodass er für die Bestrahlungsplanung gut konturiert werden kann. Eine zu hohe Kontrastmittelkonzentration (Empfehlung: <10 %) kann bei Berechnungen mithilfe des TG-43-Algorithmus, der zur Berechnung eine reine Wasserumgebung annimmt, zu großen Dosisabweichungen führen. Das liegt vor allem an dem hohen Iodgehalt in den Kontrastmittellösungen, das aufgrund seiner hohen Dichte zu Dosisreduzierungen führen kann, die vom TG-43-Algorithmus nicht berücksichtigt werden. In mehreren Sitzungen wird die Quelle durch einen Zweikanal-Katheter in den Ballon gefahren. Der Durchmesser des Ballons variiert je nach Patient und Ausführung des Ballons. Um den hohen Ansprüchen komplexer Dosisverteilungen gerecht zu werden, gibt es seit einiger Zeit Multilumen-Varianten (nicht sehr verbreitet in Deutschland), die unter Verwendung mehrerer Katheter weitere Haltepositionen ermöglichen.
Nach der chirurgischen Entfernung des Tumors, wird der MammoSite-Applikator eingesetzt und verweilt dort für die gesamte Behandlungszeit (ca. eine Woche). Am zweiten Tag wird ein Planungs-CT gefahren und basierend auf der Anweisung ein Bestrahlungsplan erstellt. In den letzten drei Tagen wird in je zwei Sitzungen pro Tag eine Dosis in einem bestimmten Abstand, in der Regel in 0,5 cm Gewebstiefe bzw. 0,5 cm von der Ballonoberfläche appliziert. Die Haut- und Rippendosis sollten eine Maximaldosis (z. B. 1,5 Gy pro Fraktion) nicht überschreiten, und bilden somit die limitierenden Faktoren der Behandlung. Je nach klinischer Erfahrung, variieren die Dosierungskonzepte und tolerierbaren Maximaldosen in den Risikoorganen.
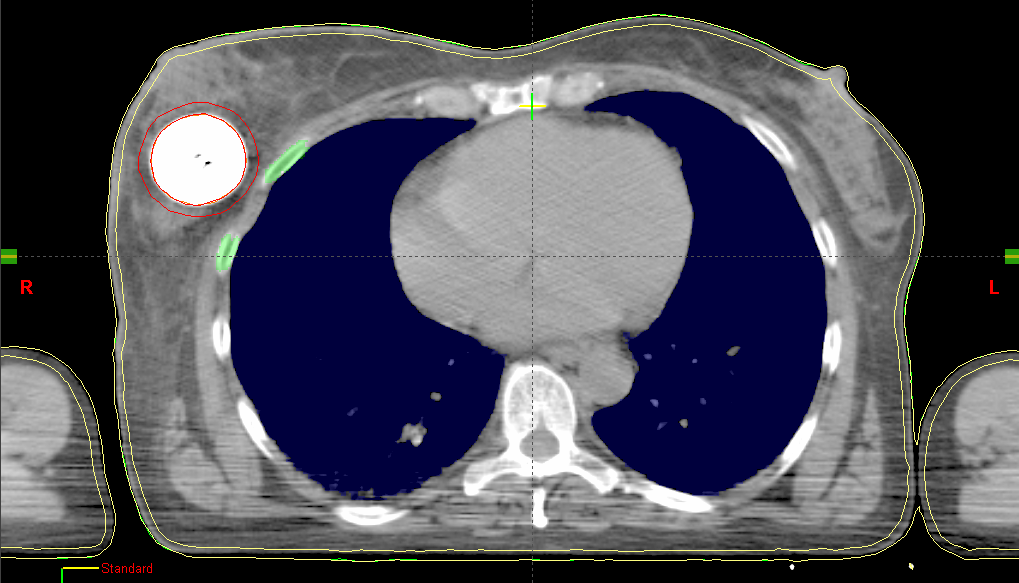
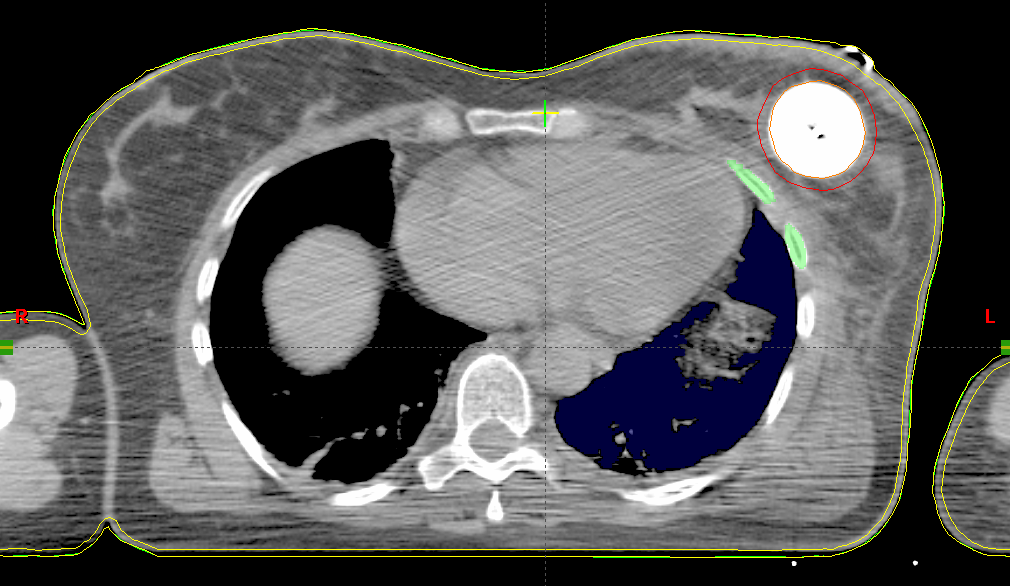
Sofern in der Computertomographie um den Ballon große Lufteinschlüsse zu sehen sind (z. B. weil die Kavität das maximale Ballonvolumen überschreitet, oder dieser nicht vollständig aufgefüllt wurde) müssen diese ebenfalls berücksichtigt werden, da Dichteinhomogenitäten vom am weitesten verbreiteten TG-43-Algorithmus nicht berücksichtigt werden. Zu diesem bekannten Problem existiert bereits eine Reihe von Publikationen. Diese beschäftigen sich überwiegend mit den Auswirkungen vom Kontrastmittel, von Lufteinschlüssen am und im Ballon und mit dem Umgebungsmedium, dass im TG-43-Formalismus als Wasser angenommen wird, woraus eine erhöhte Rückstreuung resultiert.
- Huang YJ and Blough M, Dosimetric effects of air pockets sizes in MammoSite treatment as accelerated partial breast irradiation for early breast cancer. J App Clin Med Phys, 2009;11(1):2932
- Cheng CW, Mitra R, Li XA et al. Dose pertubations due to contrast medium and air in MammoSite treatment: An experimental and Monte Carlo study. Med Phys. 2005;32(7):2279-87
- Cazeca MJ, Medich DC and Munro 3rd JJ. Effects of breast-air and breast-lung interfaces on the dose rate at the planning target volume of a MammoSite catheter for Yb-169 and Ir-192 HDR sources. Med Phys. 2010;37(8):4038-45
- Redler G, Templeton A, Zhen H et al. Dosimetric effect of saline- versus water-filles balloon applicators for IORT using the model S700 electronic brachytherapy sources. Brachytherapy. 2018;17(2):500-505
- Lymperopoulou G, Papagiannis P, Angelopoulos A et al. A dosimetric comparison of 169-Yb and 192-Ir for HDR brachytherapy of the breast, accounting for the effect of finite patient dimensions and tissue inhomogeneities. Med Phys. 2006;33(12):4583-9
Interstitielles Afterloading
Bei der interstitiellen Brachytherapie werden mithilfe von flexiblen Plastikschläuche, durch den Arbeitskanal eines Endoskops oder starren Spickungsnadeln umschlossene Strahlenquellen direkt in das Gewebe implantiert. Zielvolumen sind HNO-Tumore, Tumore und Metastasen im Becken, neuroendokrine Tumore, die weibliche Brust sowie Leber-, Nieren- und Lungenmetastasen. Theoretisch kann die interstitielle Brachytherapie überall angewendet werden, wo die Platzierung der Strahlenquelle möglich ist.
Empfohlene Volumen- & Dosisspezifikationen für interstitielle Brachytherapie finden sich im gleichnamigen ICRU-Report 58 aus dem Jahr 1997.
Prostataspickung
Vorbereitend platziert der behandelnde Arzt in Kurznarkose oder spinaler Anästhesie Spickungsnadeln in dem zu bestrahlenden Bereich der Prostata. Zur Lokalisierung der Nadeln wird eine Ultraschallsonde rektal eingeführt die mithilfe eines Ultraschallsteppers schichtweise Aufnahmen ermöglicht. Zur Fixierung werden die Nadeln in ein Template (Platte mit Löchern) gesteckt. Diese gewährleisten eine präzise Bestrahlung. Nachdem die Nadeln implantiert worden sind, wird auf Basis der Ultraschallschnittbilder eine individuelle Dosisverteilung berechnet. Diese Berechnung basiert üblicherweise auf dem TG-43 Formalismus. Die Berechnung kann entweder instantan, ohne Beendigung der Kurznarkose, erfolgen oder zu einem späteren Termin. In der Regel werden 1-2 Fraktionen angeordnet, je nachdem welches Therapiekonzept (Monotherapie oder Boost) verfolgt wird.