Inhaltsverzeichnis
Die nuklearmedizinische Therapie wird auch als Radionuklidtherapie oder molekulare Strahlentherapie bezeichnet. Das Prinzip ähnelt stark der Diagnostik. Auch hier werden Radionuklide an Tracer gebunden und anschließend dem Patienten appliziert. Ziel der Radionuklidtherapie ist aber nicht mehr die alleinige Darstellung von Stoffwechselprozessen, sondern die gezielte Zerstörung von pathologischem Gewebe.
Die primären Unterschiede der Radionuklidtherapie zur Teletherapie mit Photonen sind die verwendete Strahlungsqualität und die Dosisleistung. Da das Radionuklid mithilfe des Tracers direkt an das kranke Gewebe gebunden werden kann, werden Strahlenarten mit sehr kurzer Reichweite verwendet, um eine Dosiseskalation im kranken und eine optimale Schonung des gesunden Gewebes zu erreichen. Die Dosisabgabe erfolgt nicht wie in der Teletherapie in wenigen Minuten, sondern entsprechend der Halbwertszeit über mehrere Stunden und Tage. Verglichen mit der Teletherapie führt dies zu einer geringeren Dosisleistung und biologisch effektiven Dosis. Daraus resultieren bei der Radionuklidtherapie höhere Zieldosen.
Nuklideigenschaften
Genau wie in der Diagnostik werden bei der Radionuklidtherapie bestimmte Anforderungen an die Eigenschaften der verwendeten Nuklide gestellt:
Da bei der Radionuklidtherapie eine lokale Dosisedeposition im Vordergrund steht, werden in erster Linie β–– und α-Strahler eingesetzt. Nach dem Zerfall liegt das Tochternuklid häufig in einem angeregten Zustand vor, sodass es zudem zur Emission von γ-Strahlung kommen kann. Liegt die Emissionsenergie der γ-Strahlung in einem für die Bildgebung brauchbaren Bereich, kann so auch eine Bildgebung unter Therapie erfolgen (beispielsweise zur Therapiekontrolle und Dosimetrie). Diese Radiopharmaka werden auch als Theranostika bezeichnet (beispielsweise I-131 und Lu-177).
Die Emissionsenergie des gewählten Nuklids sollte hoch genug für eine entsprechende Dosiseskalation sein. Gleichzeitig sollte sie, insbesondere bei β-Strahlern, klein genug sein, um das umliegende Gewebe bestmöglich zu schonen. Für die Reichweite R von β-Strahlern in Gewebe gibt es folgende Faustformel:
\frac{E_{\text{β}} \, \text{in MeV}}{2} = R_{\text{Gewebe}} \, \text{in cm}Üblich sind mittlere β-Energien zwischen 100 keV und 1 MeV.
Die Anforderungen an die Halbwertszeit ähneln denen der in der Diagnostik eingesetzten Nuklide, wobei hier sehr kurze Halbwertszeiten aufgrund der notwendigen Lieferketten vermieden werden. Sehr lange Halbwertszeiten sind wiederum aufgrund von Strahlenschutzaspekten unerwünscht, sodass die verwendeten Halbwertszeiten üblicherweise in der Größenordnung mehrerer Tage liegen.
Radionuklidtherapien
An dieser Stelle möchten wir euch häufig durchgeführte Radionuklidtherapien und die dabei verwendeten Nuklide kurz vorstellen. Nähere Informationen zu den Therapien erhaltet ihr in den entsprechenden Artikeln, sofern bereits vorhanden.
Radioiodtherapie
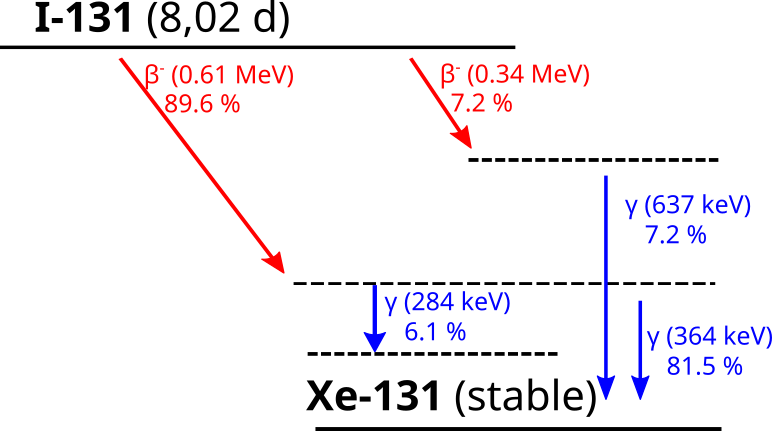
Bei der Radioiodtherapie wird I-131 Natriumiodid in Form einer Kapsel oral appliziert. I-131 zerfällt mit einer Halbwertszeit von 8,02 Tagen über den β– Zerfall in das stabile Xe-131. Das I-131 wird von den aktiven Schilddrüsenzellen aufgenommen und durch die emittierte β-Strahlung effektiv geschwächt. Da das Xe-131 unmittelbar nach dem Zerfall in einem angeregten Zustand vorliegt, kommt es zudem zur Emission von γ-Strahlung. Die häufigste Emissionsenergie von 364 keV ist für die Bildgebung verwendbar, sodass das I-131 zur Klasse der Theranostika gehört. Dies ermöglicht eine Kontrolle des anreichernden Gewebes und der Dosimetrie während der Therapie.
Die auftretende γ-Strahlung sowie die vermehrte Ausscheidung von nicht angereichertem sowie bereits verstoffwechseltem I-131 macht eine stationäre Durchführung der Therapie notwendig, um Betreuungspersonal und Familienmitglieder keiner erhöhten Strahlung auszusetzen. Maßgeblich ist hierbei der Jahresgrenzwert für die Bevölkerung von 1 mSv/a.
Typische Indikationen sind das differenzierte Schilddrüsen-Ca und benigne Erkrankungen mit erhöhter Schilddrüsenaktivität, wie manifeste sowie latente Hyperthyreose bei Autonomie und Basedow, Struma und Rezidivstruma. Angestrebte Herddosen liegen je nach Erkrankung zwischen 120 und 400 Gy. Die dabei applizierten Aktivitäten reichen je nach Stoffwechsel von ca. 100 bis 1 500 MBq (benigne) und 3 000 bis 12 000 MBq (maligne).
Die nachstehende Abbildung zeigt zwei Schilddrüsenszintigramme desselben Patienten. Links mit fokaler Autonomie vor der Therapie und rechts mit regelhafter Anreicherung nach Therapie.
SIRT (Selektive Interne Radiotherapie)
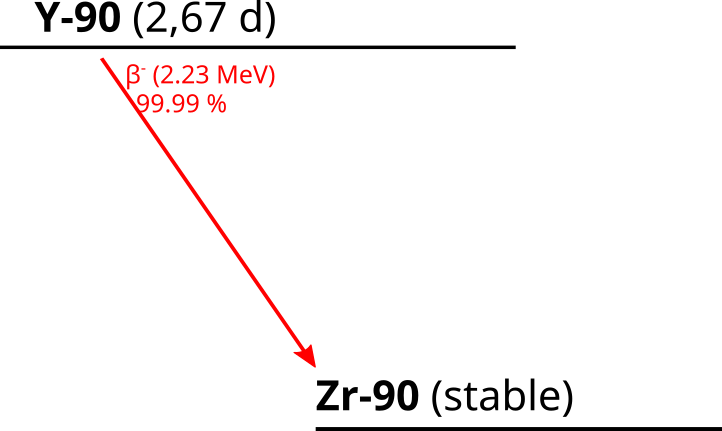
Bei der SIRT handelt es sich um eine Radionuklidtherapie zur Behandlung von Lebertumoren. Dazu werden mit Y-90 beladene Sphären (Durchmesser ca. 20 – 60 µm) aus Glas oder Resin (je nach Hersteller) unter Durchleuchtung in den arteriellen Gefäßbaum des Tumors appliziert. Das Y-90 zerfällt dort mit einer Halbwertszeit von 2,67 Tagen über den β– Zerfall in das stabile Zr-90 und wirkt dort auf zweifache Weise: Zum einen wird der Tumor durch die β-Strahlung gezielt geschwächt und zum anderen führt die durch die Sphären hervorgerufene Embolisation des Gefäßbaums zu einem Aushungern des Tumors. Dabei wird sich die Physiologie des Tumors zunutze gemacht, der im Gegensatz zum gesunden Lebergewebe fast ausschließlich arteriell versorgt wird. Durch die lokale Applikation des Radiopharmakons kann eine Dosiseskalation im Tumor erzielt werden, ohne dass umliegende, venös versorgte, Lebergewebe zu zerstören.
γ-Strahlung wird beim Zerfall von Y-90 nicht emittiert, sodass eine Therapiekontrolle nur durch Aufnahme einer Bremsstrahlung-SPECT erfolgen kann. Die vom Patienten ausgehende Strahlung ist dementsprechend vergleichsweise gering und auch Ausscheidungen des Radiopharmakons sind im Regelfall nicht zu erwarten.
Typische Indikation sind die Behandlung von Lebermetastasen mit dem Ziel des Downstagings, Bridgings oder einer Radio-Segmentektomie bei einseitigem Befall. Angestrebte Herddosen liegen bei ca. 100 – 150 Gy.
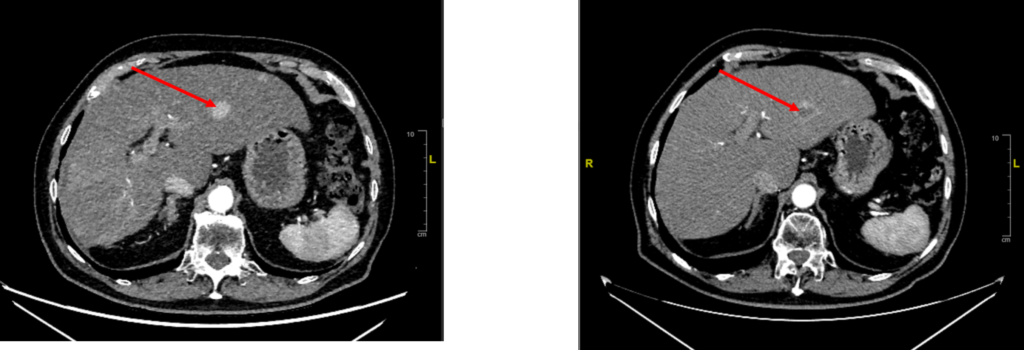
Die nachfolgende Abbildung zeigt ein Patientenbeispiel mit einem gut abgrenzbaren Tumor im linken Lebersegment vor Therapie (li.) und dem zerstörten Tumor, sichtbar als nekrotischer Schatten, nach Therapie (re.).
Ra-223 Schmerztherapie (XOFIGO)
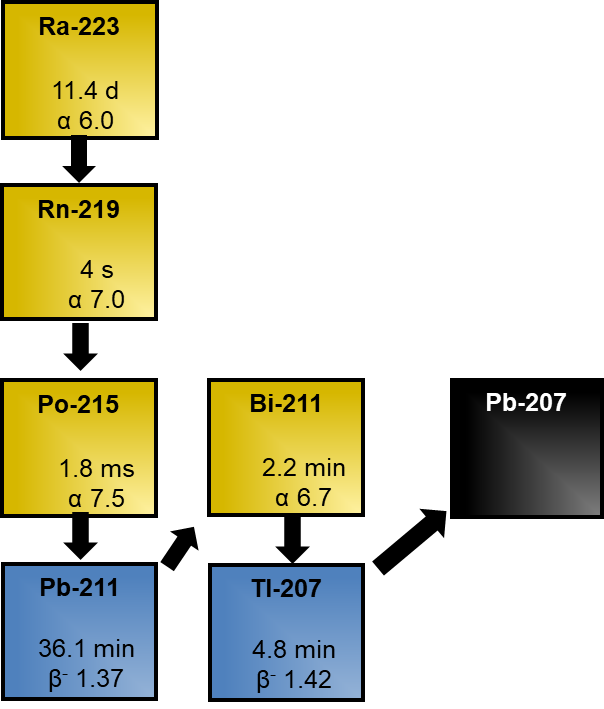
Die Ra-223 Schmerztherapie ist eine palliative Behandlung von Patienten mit kastrationsresistentem Prostata-Ca und symptomatischen Knochenmetastasen. Es erfolgt eine ambulante, intravenöse Applikation von Ra-223-dichlorid. Je nach Ansprechen und Patientenbefinden wird die Applikation bis zu sechsmal wiederholt. Die Pause zwischen zwei Applikationen beträgt vier Wochen. Nach Injektion reichert das Ra-223-dichlorid selektiv in stoffwechselaktivem Knochengewebe an und führt so im Optimalfall zu einer Reduktion der Metastasen und somit auch der Schmerzen. Das Ra-223 zerfällt über eine sechsstufige Zefallskette von α- und β-Strahlern in das stabile Pb-207. Die kurzen Halbwertszeiten der Zwischenprodukte führt jedoch dazu, dass sich nach Abtrennung schnell ein Sekundärgleichgewicht einstellt, dessen Aktivität sich mit der Halbwertszeit von Ra-223 (11,4 Tage) reduziert. Im Gleichgewicht betragen die Anteile der emittierten Zerfallsenergien:
- α: 95,3 % (5,0 – 7,5 MeV)
- β: 3,6 % (0,45 – 0,49 MeV)
- γ: 1,1 % (0,01 – 1,3 MeV)
Die Berechnung der Applikationsaktivität erfolgt aktuell noch gewichtsbezogen und beträgt 55 kBq/kg. Die in Deutschland verfügbare gebrauchsfertige Lösung ist unter dem Namen XOFIGO (Fa. Bayer) bekannt.
Therapie mit Lu-177
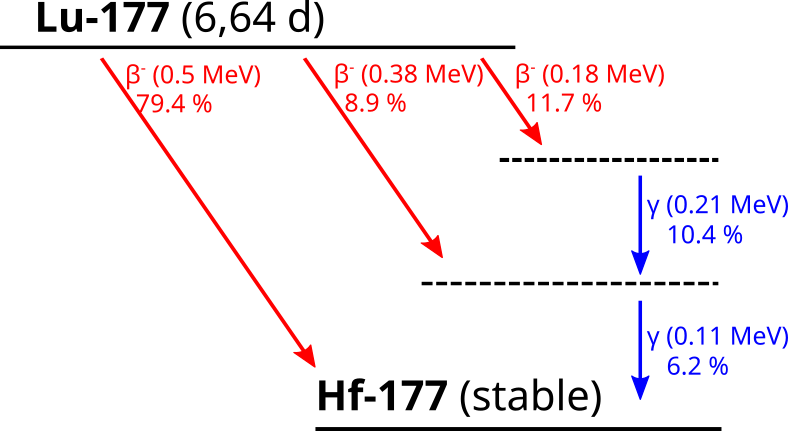
Bei den zugelassenen Radioligandentherapien (RLT) Lutathera und Pluvicto (Fa. Novartis) wird der β-Strahler Lu-177 als Radionuklid eingesetzt. Das Lu-177 zerfällt über β– Zerfall in das stabile Hf-177. Dabei kommt es in ca. 20% der Fälle zu einer Folgeemission von γ-strahlung, die für die Bildgebung und Dosimetrie genutzt werden kann (208 und 110 keV). Folglich handelt es sich bei Lu-177 um ein Theranostikum. Das Lu-177 wird über einen Komplexbildner (1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraessigsäure, genannt DOTA) an ein [Tyr3]Octreotid-Analogon (genannt TATE) gebunden.
Lutathera
Lutathera kommt zur Behandlung von nicht resezierbare oder metastatisch, progressive, gut differenzierte (G1 und G2) somatostatinrezeptorpositive gastroenteropankreatische neuroendokrine Tumore (GEP-NETs) zum Einsatz.
Das Lu-177 wird über einen Komplexbildner (1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraessigsäure, genannt DOTA) an ein [Tyr3]Octreotid-Analogon (genannt TATE) gebunden. Bei Octreotid handelt es sich um ein synthetisches Analogon des Peptidhormons Somatostatin, das schließlich an die Somatostatinrezeptoren des Tumors bindet. Die Anwendung wird deshalb auch Peptid-Rezeptor-Radionuklid-Therapie (PRRT) genannt.
Das Radiopharmakon (auch 177Lu-DOTATATE genannt) kann dabei von einer hausinternen Radiochemie hergestellt oder als gebrauchsfertige Injektionslösung erworben werden (Lutathera).
Aktuell erfolgt noch eine intravenöse Standardapplikation von 7,4 GBq. Die Applikation kann bis zu viermal wiederholt werden. Die Pause zwischen zwei Applikationen beträgt dabei acht Wochen.
Pluvicto
Bei Pluvicto handelt es sich um ein zugelassenes Fertigarzneimittel der Firma Novartis Pharma Gmbh zur Durchführung der Radioligandentherapie (RLT) mit 177Lu-PSMA-617 beim progredienten Prostataspezifischen-Membranantigen-(PSMA-)positiven, metastasierten, kastrationsresistenten Prostatakarzinom (mCRPC).
Die Injektionslösung enthält als Wirkstoff (177Lu) Lutetiumvipivotidtetraxetan (177Lu-PSMA-617). 177Lu-PSMA-617 gehört zu den Radiologanden-Therapeutika. Über eine DOTA (1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraessigsäure)-Chelator-Verbindung wird das therapeutisch wirksame Radionuklid Lu-177 durch Komplexisierung gebunden. Mit dem anderen Ende bindet PSMA-617 an das prostataspezifische Membranantigen (PSMA), das von den Zellen eines Prostatakarzinoms exprimiert wird. Dies ermöglicht eine lokale Bestrahlung der Tumorzellen mit dem β-γ-Strahler Lu-177.
Verteilung der Radionuklidtherapien
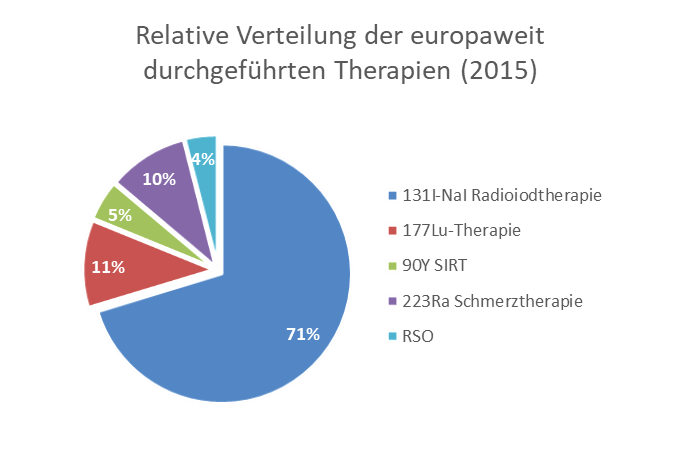
Die nachstehende Abbildung zeigt das Ergebnis einer europaweit durchgeführten Studie der EANM (European Association of Nuclear Medicine) zur relativen Verteilung der Radionuklidtherapien. Es ist deutlich erkennbar, dass die Radioiodtherapien nach wie vor die am häufigsten vertretene Therapieform ist. Aufgrund guter Evidenzen und steigender Verfügbarkeit steigen aber zunehmend auch die Anteile der anderen Therapieformen.
Nuklearmedizin
Vorwort Die Nuklearmedizin ist der Bereich, in dem Kernphysik auf Medizin trifft. Hier werden dem Patienten γ-, β- oder sogar α-Strahler appliziert. Welcher Strahler verwendet
Radioiodtherapie
Die orale Applikation von Iod-131 (I-131) NaI bei benignen (Hyperthyreose) sowie malignen (differenziertes Schilddrüsenkarzinom) Schilddrüsenerkrankungen wird bereits seit 1941 durchgeführt. Damit ist die Radioiodtherapie (RIT) die
Lutathera
Das radioaktive Element Lutetium (Lu)-177 (β– -Strahler) wird in der Nuklearmedizin unter anderem zur Therapie von sog. Somatostatinrezeptor-exprimierende Tumoren eingesetzt. Darunter versteht man solche Tumore,
Pluvicto
Bei Pluvicto handelt es sich um ein zugelassenes Fertigarzneimittel der Firma Novartis Pharma Gmbh zur Durchführung der Radioligandentherapie (RLT) mit 177Lu-PSMA-617 beim progredienten Prostataspezifischen-Membranantigen-(PSMA-)positiven, metastasierten,